Ассоциация в растворах электролитов — особенности процесса и возможные причины
1 минута чтение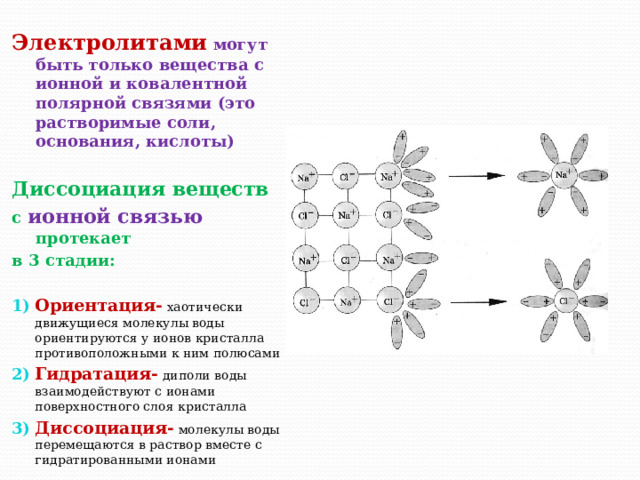
Ассоциация в растворах электролитов – явление, которое играет важную роль в химической и физической химии. Оно заключается в образовании ассоциатов или ионных комплексов в растворе. Ассоциация происходит как в растворах с ионной связью, так и в растворах с ковалентной связью.
В растворах с ионной связью ассоциация происходит за счет образования ионных комплексов, которые образуются между положительно и отрицательно заряженными ионами. Этот процесс иллюстрируется электролитом, который расщепляется на ионы в растворе. При наличии ионов с разной зарядностью, они притягиваются друг к другу и образуют ионные комплексы. Такой процесс приводит к увеличению электропроводности раствора и может влиять на химические реакции, происходящие в системе.
В растворах с ковалентной связью ассоциация происходит за счет образования молекулярных комплексов. В этом случае, молекулы электролитов образуют слабые связи друг с другом, что приводит к образованию ассоциатов. Такие ассоциаты могут иметь лабильный характер и разрушаться при изменении условий растворения, таких как температура или концентрация растворителя.
Причины ассоциации в растворах электролитов могут быть разными. В случае растворов с ионной связью, это может быть обусловлено притяжением противоположно заряженных ионов, образованием водородных связей или просто силой кулоновского взаимодействия. В случае растворов с ковалентной связью, ассоциация происходит за счет образования слабых связей, таких как ван-дер-ваальсовы силы или диполь-дипольные взаимодействия. Более сложные причины ассоциации в растворах электролитов требуют дальнейшего изучения и исследования.
Ассоциация электролитов в растворах: ионная и ковалентная связь
Ионная связь характеризуется образованием электростатических взаимодействий между положительно и отрицательно заряженными ионами. Вода, как универсальный растворитель, играет важную роль в ассоциации электролитов с ионной связью. Молекулы воды ориентируются вокруг ионов, образуя гидратные оболочки, которые сохраняют заряд иона и позволяют ему двигаться в растворе.
Ковалентная связь проявляется в растворах, содержащих молекулы электролитов с ковалентными связями. В таких случаях, ассоциация электролитов происходит благодаря слабым межмолекулярным взаимодействиям, таким как водородные связи или взаимодействия Диполь-Диполь.
Ассоциация электролитов в растворах может быть обусловлена различными причинами. Одна из них — дефекты кристаллической решетки электролита, которые приводят к выделению в раствор свободных ионов. Другой причиной может быть процесс диссоциации, когда ионы электролита разделяются на заряженные частицы при взаимодействии с растворителем.
Ассоциация электролитов в растворах имеет большое значение в различных областях науки и техники. Она влияет на проводимость электричества в растворах, скорость химических реакций, физические свойства растворов, а также на множество других процессов и явлений.
| Ионная связь | Ковалентная связь |
|---|---|
| Основана на электростатическом взаимодействии заряженных ионов | Образуется между атомами путем обмена или совместного использования электронов |
| Традиционно свойственна солям и кислотам | Свойственна молекулам с ковалентными связями |
| Происходит в растворах с водой и другими полярными растворителями | Происходит в растворах с не полярными или слабо полярными растворителями |
Особенности процесса
Процесс ассоциации в растворах электролитов с ионной и ковалентной связью имеет ряд особенностей, которые необходимо учитывать при исследовании данного явления.
| Особенность | Описание |
| 1. Влияние концентрации | Концентрация раствора электролита оказывает существенное влияние на процесс ассоциации. При увеличении концентрации, количество образующихся ассоциатов также увеличивается. |
| 2. Размер молекул ассоциатов | Молекулы ассоциатов в растворах электролитов могут иметь различный размер, что влияет на их скорость образования и разрушения. |
| 3. Реакция на изменение pH | pH раствора также влияет на процесс ассоциации. Изменение pH может привести к изменению заряда молекул электролитов и, следовательно, к изменению скорости и степени ассоциации. |
| 4. Влияние температуры | Температура также оказывает влияние на процесс ассоциации в растворах электролитов. При повышении температуры образование и разрушение ассоциатов происходит быстрее. |
Учет данных особенностей процесса ассоциации позволяет более точно описывать и понимать поведение электролитов в растворах и причины, обусловливающие данный процесс.
Ионная связь в растворах
Когда электролит растворяется в воде, его атомы или молекулы расщепляются на положительные и отрицательные ионы. В результате образуется ионная решетка, где катионы и анионы находятся вблизи друг друга, под действием электрических сил.
В растворах ионные связи могут быть слабыми или сильными, в зависимости от энергии связи между ионами. Сильные ионы, такие как Na+ и Cl-, обычно образуют кристаллические сетки в твердом состоянии, которые легко расщепляются при растворении.
Ионные связи в растворах обладают рядом особенностей, таких как высокая проводимость электрического тока, из-за наличия свободных ионов, которые движутся под действием электрического поля. Также, ионные связи в растворах могут образовывать комплексы, когда ионы взаимодействуют с другими молекулами или ионами, изменяя свое окружение и свойства.
Особенности процессов с ионной связью в растворах могут быть объяснены рядом факторов, таких как растворимость электролита, его ионный радиус, электроны образования комплексов, и многими другими. Понимание этих особенностей позволяет правильно интерпретировать и объяснить различные реакции и свойства растворов электролитов.
Ковалентная связь в растворах
Ковалентная связь представляет собой тип химической связи между атомами, в которой электроны общего пользования, называемые валентными электронами, образуются путем обмена между атомами. Этот тип связи характеризуется возникновением сильных, но локализованных электронных пар между атомами.
Однако в растворах ковалентная связь проявляет некоторые особенности. Во-первых, растворенные ковалентные соединения, такие как молекулы газов или жидкостей, могут более свободно двигаться и взаимодействовать с другими составляющими раствора. Это обусловлено отсутствием жесткой решетки, характерной для твердых ковалентных соединений.
Во-вторых, в растворах ковалентные связи могут быть нарушены в результате взаимодействия со средой или другими молекулами. Это может привести к разришению молекул на ионы или образованию комплексов, что изменяет их химическую активность и стабильность.
Наконец, растворенные ковалентные соединения также могут образовывать ассоциаты — пары или группы молекул, связанных слабыми взаимодействиями типа водородной связи или диполь-дипольного взаимодействия. Это приводит к образованию клатратов и супрамолекулярных структур в растворах.
Возможные причины
Ассоциация в растворах электролитов может быть обусловлена различными факторами. Рассмотрим некоторые из них:
- Электростатическое притяжение. Ионы электролита обладают электрическим зарядом, поэтому они могут притягиваться друг к другу под воздействием электростатических сил.
- Роль растворителя. Влияние растворителя на процесс ассоциации может быть связано с различными факторами, включая поляризуемость молекул растворителя и его способность образовывать водородные связи.
- Концентрация электролита. При высоких концентрациях электролитов, ионы могут быть ближе друг к другу, что способствует их ассоциации.
- Температура. Возможность ассоциации электролитов может зависеть от температуры раствора. Например, при понижении температуры, ассоциация электролитов может увеличиваться.
- Наличие других реагентов. Некоторые вещества, присутствующие в растворе, могут способствовать ассоциации электролитов, например, образование комплексов или сопряженных кислотно-основных реакций.
Обратите внимание, что эти причины могут исследоваться и дополняться более глубоким и детализированным анализом.
Влияние концентрации раствора
В случае растворов электролитов с ковалентной связью, увеличение концентрации раствора приводит к увеличению количества молекул электролита в растворе. Это может привести к повышению вероятности столкновений между молекулами, что способствует образованию связей между ними и увеличению степени ассоциации.
Важно отметить, что влияние концентрации раствора на процесс ассоциации может быть различным в зависимости от химической природы электролита и условий эксперимента. Например, некоторые электролиты могут образовывать большее количество ионных связей при повышенной концентрации, в то время как другие электролиты могут проявлять обратную зависимость.
Таким образом, концентрация раствора является важным фактором, определяющим степень ассоциации электролита в растворе. Изучение влияния концентрации позволяет лучше понять процессы, происходящие в растворах электролитов с ионной и ковалентной связью и их особенности.
Электростатические силы притяжения
Электростатические силы притяжения могут быть рассчитаны с использованием закона Кулона, который устанавливает, что сила притяжения пропорциональна произведению зарядов и обратно пропорциональна квадрату расстояния между заряженными частицами.
Электростатические силы притяжения являются основным фактором, который влияет на стабильность ассоциатов. Благодаря этим силам, молекулы электролита могут образовывать ассоциации в растворе.
Кроме того, электростатические силы притяжения играют важную роль в процессе растворения ионов. Когда растворяется электролит, ионы разделяются и окружаются молекулами растворителя. Электростатические силы притяжения помогают удерживать ионы в растворе и предотвращают их обратное соединение.
| Пример | Ионы | Заряд |
|---|---|---|
| Натрий хлорида (NaCl) | Натрий (Na+) | Положительный |
| Хлор (Cl-) | Отрицательный |
В случае NaCl, положительно заряженные натриевые ионы и отрицательно заряженные хлоридные ионы притягиваются друг к другу электростатическими силами притяжения, что приводит к образованию ассоциаций в растворе.
Вопрос-ответ:
Какая основная разница между ионной и ковалентной связью?
Основная разница между ионной и ковалентной связью заключается в том, как электроны распределены между атомами в связи. В ионной связи электроны полностью переходят от одного атома к другому, образуя два иона с противоположным зарядом. В ковалентной связи электроны между атомами разделяются, создавая общий электронный облако.
В каких растворах проявляется явление ассоциации электролитов?
Явление ассоциации электролитов проявляется в растворах, где электролиты ионизируются в ионы и образуют ассоциаты. Это особенно характерно для растворов сильных электролитов, таких как кислоты, щелочи и соли. В этих растворах ионы электролитов могут образовывать ассоциаты и агрегаты различных размеров и структур.
Какие причины могут вызывать ассоциацию электролитов в растворах?
Ассоциация электролитов в растворах обусловлена несколькими факторами. Первая причина — это электростатическое притяжение между положительно и отрицательно заряженными ионами. Вторая причина — это взаимодействие с диссоциационным растворителем, которое может способствовать образованию ассоциатов. Третья причина — это взаимодействие ионов электролитов с растворителем через образование водородных связей или других типов химических связей.
Какие особенности проявляет ассоциация в растворах электролитов с ионной связью?
Ассоциация в растворах электролитов с ионной связью проявляется в образовании ассоциатов, состоящих из ионов электролитов. Эти ассоциаты могут быть как одномоментными, содержащими два иона, так и многомоментными, содержащими больше двух ионов. Они образуются благодаря электростатическому притяжению между положительно и отрицательно заряженными ионами и могут обладать различными структурами и свойствами.
Что такое ассоциация в растворах электролитов?
Ассоциация в растворах электролитов — это процесс, при котором электролит в растворе распадается на ионы. Вода, являющаяся полюсным растворителем, притягивает ионы электролита и разрывает связи между ними. Таким образом, образуются ионы, которые способны проводить электрический ток.





